【指南与共识】中国左心耳封堵预防心房颤动卒中专家共识(2019)
发布时间:2019-12-28 16:26:11
本文刊于:中华心血管病杂志2019,47(12):937-955
作者:中华医学会心血管病学分会 中华心血管病杂志编辑委员会
摘要
左心耳封堵(LAAC)预防非瓣膜性心房颤动卒中的疗效和安全性已被多个随机对照和注册研究所证实,也已被多个指南推荐用于具有高卒中风险房颤患者卒中的预防。然而,LAAC作为一种新兴技术,其应用不能仅限于指南所涉及适应证和禁忌证的讨论,还应包括该技术所涉及的多种器械和操作的综合应用,影像学指导和评估,并发症处理,围术期及术后用药,以及术后管理等多方面内容。鉴于现有循证医学证据和指南推荐很难涵盖上述所有方面,因此中华医学会心血管病分会和中华心血管病杂志编辑委员会组织不同领域的专家,经充分讨论,最终形成了本共识。根据现有的循证医学证据和临床实践经验,本共识对LAAC及其相关技术应用的合理性、是否有更多临床获益或更少操作相关并发症给予适合(合理,有更多获益或更少并发症)、不确定(有一定合理性,但尚需更多证据)和不适合(不一定合理,不太可能获益或有更多并发症)3种不同等级的推荐,以指导和规范LAAC及其相关技术的临床应用。
心房颤动(房颤)是心血管病学科发展最快的领域之一。近年来,除治疗药物和治疗理念更新外,技术上更是日新月异。左心耳封堵(left atrial appendage closure,LAAC)技术自2001年开始临床应用以来已取得了快速发展,目前在全球范围内主要有内塞型(以美国Watchman/Watchman FLX为代表)和外盖型[以中国LAmbre、LACbes和美国AMPLATZERTM Cardiac Plug(ACP)/Amulet为代表]两大类型、十余种左心耳封堵器[1]用于临床。随着PROTECT AF和PREVAIL两个随机对照研究[2,3,4,5]和多个注册研究[6,7]中长期随访结果的发布,LAAC预防房颤卒中的疗效及安全性已被确认,并且被中国、美国、欧洲等多个国际指南[8,9,10,11,12]推荐用于非瓣膜性房颤(non-valvular atrial fibrillation,NVAF)卒中的预防。
LAAC除涉及适应证和禁忌证外,还涉及多种器械和操作的综合应用,多种影像学评估、指导和随访,并发症处理,围术期及术后用药,以及术后管理等多方面内容。然而,现有循证医学证据不能涵盖所有方面,技术和操作方面也缺乏指南的具体推荐,因此在临床实践过程中LAAC技术的应用存在较大差异。中华医学会心血管病学分会和中华心血管病杂志编辑委员会组织不同领域和亚学科的专家,经过多轮讨论,编写了本共识,以指导和规范LAAC技术的临床应用。本共识按照现有的循证医学证据和长期积累的临床实践经验,根据LAAC及其相关技术的合理性、是否有更多的临床获益或更少的操作相关并发症,对纳入推荐的每一个指标,分别给予适合(具有合理性,采用该技术患者很可能有更多临床获益或更少操作相关并发症),不确定(具有一定合理性,但常规使用是否获益尚需积累更多证据)或不适合(不一定合理,采用该技术不太可能有临床获益或可能有更多的操作相关并发症)的推荐(表1)。
一、房颤流行病学
房颤是中老年最常见的心律失常。欧洲一项流行病学研究显示,房颤的发病率在50岁以下低于2%,50~61岁增加到2.1%~4.2%,62~72岁为7.3%~11%,73~79岁为14.4%,80岁以上显著增加到17.6%[13];2013年美国流行病学调查资料显示,美国房颤患者为600万~700万例[14];2014年《中国心血管病报告》指出,中国30~85岁之间房颤患病率为0.77%,据此估算中国房颤患者介于800万~1 000万例之间[15]。随着人口老龄化的加剧和房颤诊断、筛查手段的改进,房颤发病率还会进一步上升,房颤引起的各种症状和相关并发症已成为现代社会所面临的一项重大健康问题。
二、房颤卒中风险的评估和抗凝治疗
血栓栓塞性并发症是房颤致死、致残的主要原因,其中缺血性卒中是最常见的表现形式。房颤患者发生缺血性卒中的总体风险为20%~30%,与房颤的类型无关[8],房颤所致卒中占所有脑卒中的20%。同时,房颤患者往往合并高血压、糖尿病、心力衰竭、冠心病等多个危险因素,这些因素不仅与房颤的发病和复发有关,也增加发生缺血性卒中和其他系统性血栓栓塞事件的风险。
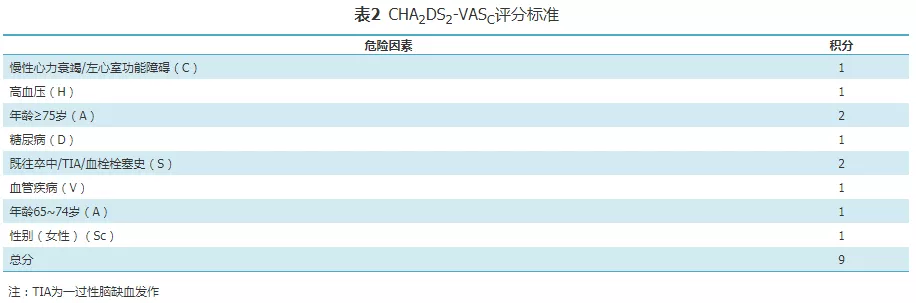
CHA2DS2-VASc评分(表2)自2010年首次被欧洲心脏病协会(ESC)房颤管理指南[16]引用以来,目前已在全球范围内被广泛用于房颤卒中风险的评估和是否启动抗凝治疗的依据。2016 ESC房颤管理指南[8]建议,男性CHA2DS2-VASc评分≥2分,女性≥3分,发生血栓栓塞性事件的风险明显增高,建议给予长期抗凝治疗(Ⅰ,A)。
然而,抗凝治疗客观上存在一定的出血风险,患者也存在不依从或不耐受长期抗凝治疗的主观原因(如担心出血、拒绝或不按医嘱服药等)。在ARISTOLE[17]、ROCKET-AF[18]和RE-LY[19]等大型随机化对照研究(RCT)中,包括接受非维生素K拮抗剂口服抗凝药(non-vitamin K antagonist oral anticoagulant,NOAC)或华法林在内的受试者每年大出血事件发生率介于2.13%~3.6%,每年大小出血事件的累计发生率介于14.4%~25.6%,受试者因发生出血或担心出血等原因,停药率高达16.6%~25.3%。真实世界中,这一比例更高。欧洲的数据显示,房颤患者接受抗凝治疗的比例仅50%[20],抗凝治疗5年后停药率高达70%[21];而中国的房颤患者接受抗凝治疗的比例不足10%[22],而且抗凝治疗3个月后22.1%的患者停药,1年后44.4%停药,随访至2年有近60%的患者停药[23]。上述数据表明,因为抗凝治疗本身的出血风险和患者拒绝/不依从/不耐受长期抗凝治疗等主客观因素的存在限制了抗凝治疗预防房颤卒中的价值,所以需要一种安全有效的替代方法。
三、LAAC的理论基础、技术可行性及循证医学证据
房颤引发的血栓栓塞事件源于左心房内形成的血栓脱落。既往研究发现,在NVAF患者中,90%以上的左心房血栓位于左心耳[24,25,26],而最新的一项研究显示,NVAF患者只要有心原性血栓形成,都会存在于左心耳,无论是否伴有非心耳的血栓[27]。因此,理论上而言,通过包括LAAC在内的技术将左心耳隔绝于系统循环之外,就能从源头上预防绝大多数的血栓形成和脱落引起的血栓栓塞事件,这正是LAAC预防房颤卒中的重要理论基础。
通过导管递送系统,将预制、预装的左心耳封堵装置输送并固定于左心耳,以覆盖或填塞的方式隔绝左心耳与左心房的血流交通,技术上完全可行,是目前所有经心内膜封堵左心耳装置的设计原则。在规范操作的前提下,LAAC手术的学习曲线相对较短,手术安全性随着经验积累不断提高。以Watchman左心耳封堵器为例,在2005年开展的PROTECT AF研究中LAAC手术成功率仅为91%,围手术期并发症高达8.4%[2],但随着产品的进一步优化,术者的操作经验逐渐提高,"PASS"原则等标准的建立,到2010—2014年开展的PREVAIL研究中,手术成功率提高到95.1%,7 d围手术期主要不良事件发生率则大幅降低到4.2%[3],到2016年发布的EWOLUTION多中心注册研究中手术成功率更是提高到98.5%,围手术期主要不良事件率则降低到2.7%[28]。尽管其他类型封堵器如ACP/Amulet和LAmbre在设计理念和操作上与Watchman不同,但具有类似的手术成功率和安全性[29,30,31,32,33]。
Watchman是第一个进入临床研究阶段、随后获得FDA批准和指南推荐的左心耳封堵装置,也是目前循证医学证据最多的左心耳封堵装置。其中,PROTECT AF和PREVAIL是两个最主要的与华法林标准抗凝治疗对照的RCT研究[3,4,5]。这两个研究中长期随访结果显示,使用Watchman装置进行LAAC在预防卒中/系统性血栓/心血管死亡的复合终点事件发生率方面不劣于甚至优于华法林,在降低心血管死亡/不明原因死亡、致残/致死性卒中、出血性卒中和主要出血事件上优于华法林[3,4,5]。此外,根据来自PROTECT AF研究707例患者和CAP注册研究566例患者终点事件的事后分析,将扣除华法令组的获益作为年净获益,使用Watchman装置封堵左心耳在减少缺血性卒中、颅内出血、大出血、心包积液和死亡等临床事件方面,在PROTECT AF研究中的1 623例患者年净获益率为1.73%,在CAP研究中的741患者年净获益率为4.97%;既往有缺血性卒中/短暂性脑缺血发作(TIA)史的患者在CAP研究中的年净获益率明显高于PROTECT AF研究(8.68%比4.30%);而且该研究还显示卒中风险评分(CHADS2评分)越高,临床净获益越大[7]。
然而,上述LAAC的循证医学证据是基于LAAC同华法林比较获得的,长期以来仍然缺乏与NOAC相比较的大型RCT研究证据。2019欧洲心脏大会上公布的首个小样本的随机化PRAGUE-17研究[34],旨在评价LAAC(其中38.7%为Watchman,61.3%为Amulet封堵器)是否不亚于NOAC,经过30个月随访,LAAC组在降低全因卒中/TIA/心血管死亡的复合终点事件发生率上不亚于NOAC。最近两项荟萃分析也显示,LAAC在预防死亡、卒中或系统性血栓事件上与NOAC相当甚至更优,而且这种优势随时间推移更为显著[35,36]。除了Watchman与ACP/Amulet,其他类型左心耳封堵装置的循证医学证据相对较少,目前Amulet与Watchman装置直接比较的Amulet IDE研究[37]还在进行当中;近年来国产LAmbre封堵装置(深圳先健公司)的临床试验结果也受到瞩目,初步研究显示使用LAmbre装置封堵左心耳的手术成功率为99%~100%,手术并发症为3.3%~6.7%,152例接受LAmbre左心耳封堵装置的患者中随访1年仅有1例发生TIA和3例小出血事件,未观察到器械相关血栓形成,显示LAmbre左心耳封堵装置的安全性和有效性不劣于于国外同类产品[32,33]。
四、LAAC的适应证与禁忌证建议
(一)LAAC的临床应用及适应证建议
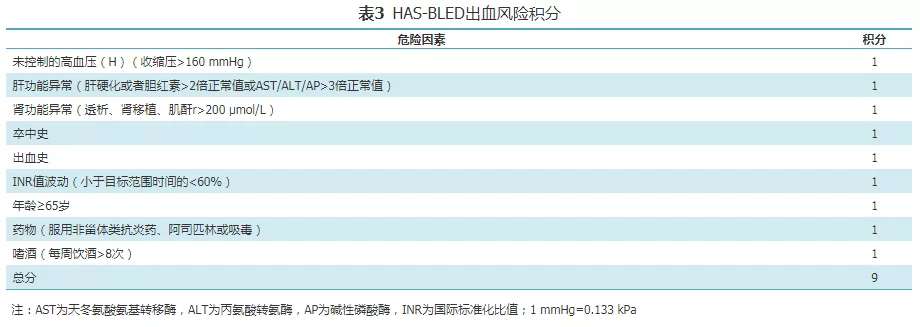
尽管介入LAAC技术从2001年就开始用于临床,但直到2012年才首次被ESC房颤管理指南推荐用于具有长期抗凝禁忌或存在高出血风险(HAS-BLED评分>3分,评分标准见表3),不适合长期抗凝的NVAF患者卒中的预防(Ⅱb)[8]。随后4年由于没有新的随机对照研究证据公布,2016年ESC房颤管理指南[38]对LAAC的建议未进行更多更新。但2017年发布的LAAC慕尼黑共识[39]和2019年发布的欧洲心律协会(EHRA)/欧洲心血管介入协会(EAPCI)关于LAAC专家共识更新[40]中,分别对LAAC的潜在适应证和操作过程中使用的器械、影像学评估及相关技巧给予了具体建议。
美国LAAC正式开始临床应用相对较晚,2014年美国心脏病学学会(ACC)/美国心脏协会(AHA)/心律协会(HRS)以缺乏足够证据和FDA尚未批准为由,没有在其房颤管理指南中对LAAC的临床应用作出推荐[41],但同年AHA/美国卒中协会指南则对LAAC的应用给予Ⅱb推荐(证据级别B)[10]。2015年3月美国FDA正式批准Watchman左心耳封堵装置用于临床,并对LAAC纳入医保支付的适应证范围进行了说明[42]。随着LAAC预防房颤卒中有效性和安全性中长期证据的积累,2019年ACC/AHA/HRS在其更新版房颤管理指南中,把LAAC列为Ⅱb类推荐,用于具有高卒中风险、不能耐受长期抗凝治疗的NVAF患者卒中的预防[11]。
自2014年3月Watchman左心耳封堵装置被国家食品药品监督管理总局批准用于临床以来,LAAC在中国的临床应用取得了快速发展。中华医学会心脏电生理和起搏分会、中国医师协会心律学专业委员会联合发布的《心房颤动:目前的认识和治疗建议-2015》[9]和《心房颤动:目前的认识和治疗的建议-2018》[12],均对LAAC预防NVAF血栓事件给予了Ⅱa类推荐(证据级别B),对LAAC的适应证也进行了说明。
然而,以上建议的推荐都是在房颤治疗背景下,是否应用于LAAC的推荐?而实际上在LAAC越来越广泛使用的情况下,迫切需要有对该技术在房颤卒中预防的具体临床情况的技术应用、操作流程进行规范性指导的专家共识,而非简单地停留在Ⅱa或者Ⅱb适应证的讨论。因此,本共识专家委员会认为,应对不同的临床情形,包括卒中风险评分,抗凝药物长期坚持的可能性与可行性,出血风险评估以及患者的意愿等具体分析,对LAAC的适应证及其相关技术的应用给予不同级别的建议(表4)。
(二)LAAC禁忌证及排除指征
患者存在下列任何一种情况,均不适合立即进行LAAC手术。(1)术前经食管超声心动图(transesophageal echocardiography,TEE)或心脏CT成像(cardiac CT angiography,CCTA)检查探测到左心房或左心耳内血栓或疑似血栓者;(2)术前TEE检查提示左心耳解剖结构复杂(如左心耳开口过小或过大,或解剖结构复杂无合适封堵器选择),在现有技术和设备条件下不适合左心耳封堵者;(3)经胸心脏超声心动图(transthoracic echocardiography,TTE)检查提示左心室射血分数(left ventricular ejection fraction,LVEF)<30%者;(4)TTE检查提示心底部或后壁存在10 mm以上心包积液,且原因未明者;(5)存在需要长期抗凝治疗的除房颤以外的其他疾病(如机械瓣换瓣术后,自发或复发性静脉血栓栓塞等);(6)存在风湿性心脏瓣膜病,二尖瓣狭窄(瓣口面积<1.5 cm2)或机械瓣换瓣术后;(7)存在严重的心脏瓣膜病或心脏结构异常(如巨大房间隔缺损、室间隔缺损)需要外科处理,或者严重的冠心病需行冠状动脉旁路移植术者;(8)新发缺血性卒中/TIA不伴有出血转化,但经美国国立卫生研究院卒中量表评分[8]和神经内科医师评估不适合启动抗凝治疗者;(9)急性缺血性卒中伴出血转化或口服抗凝治疗引发颅内出血,经多学科评估不适合重启抗凝治疗者;(10)预计生存期<1年;(11)未控制的纽约心功能分级Ⅳ级的心力衰竭。
五、术前准备
(一)术前检查
LAAC术前必需进行相关影像学和血液检查,明确心脏和左心耳解剖情况、心功能、凝血功能、肝肾功能和血常规以及其他临床情况。LAAC术前影像学检查的建议见表5。
1.TTE:
术前TTE检查非常重要,可以明确LVEF、左心房大小、房间隔及其他心脏结构和瓣膜情况,是否存在心包积液等信息,建议LAAC术前1周内进行TTE检查。
2.TEE:
TEE可显示二维和三维静态和动态图像,对LAAC术前评估中的价值最为重要,不仅可以评估左心耳形态和结构、测量左心耳开口宽度及深度,为封堵器大小选择提供参考,还可以鉴别血栓和评估左心房自发显影程度,及时发现不适合LAAC手术的情况,因此TEE已被多个国际指南/专家共识[43,44]推荐用于LAAC术前评估、术中监控和术后随访。2015年美国SCAI/ACC/HRS联合发布的LAAC共识[44]中还声明,开展LAAC手术的医院必须配备专业的TEE装备及有经验的操作师。因此,本共识推荐:在LAAC术前评估、术中指导和监控,以及术后随访中常规使用TEE。
术前TEE检查中,应该至少从0°、45°、90°和135° 4个角度观察左心耳形态及分叶、最大开口直径、可用深度(着陆区深度)、左心房和左心耳内血栓情况和自发显影程度描述、左心耳内梳状肌位置及分布。此外,还需描述房间隔状态(如缺损,房间隔瘤或卵圆孔未闭)以及二尖瓣、肺静脉等左心耳邻近结构情况。有研究指出,TEE测量的左心耳开口宽度与造影测量值和CCTA测量值存在微小差别(往往偏小)[45],在LAAC术中需要考虑这个差别慎重选择封堵器尺寸。此外,有极少部分患者因为存在食管疾患不能耐受TEE检查,这种情况需要有替代方案。常用的替代方案有,LAAC术前评估和术后随访中可使用CCTA检查,术中监控和评估过程中可使用心腔内超声(intracardiac echocardiography,ICE)。术前TEE检查通常建议在LAAC术前48 h内进行,如术前TEE检查超过48 h,在LAAC术前应先进行TEE检查(TEE禁忌时可用ICE替代),确认左心房/左心耳内无血栓的前提下进一步行LAAC手术。
3.CCTA:
如果患者因食管疾病不能耐受TEE检查或TEE检查失败者,LAAC术前评估和术后随访可使用CCTA替代。通常情况下,CT测量的左心耳开口宽度比TEE测量结果偏大约3 mm[46],因此,选择封堵器尺寸时需要考虑这个差别。此外,CCTA检查探测左心房和左心耳内血栓的敏感性和特异性均低于TEE[47,48,49,50,51,52],这可能与左心耳内具有发达的梳状肌和对比剂不能完全充盈左心耳有关。因此CCTA检查时需要有经验的影像学医师通过调节门控时间延迟显影等方法进一步明确对比剂充盈心耳远端。
4.其他检查:
接受LAAC手术的患者年龄多偏大,有些还曾发生脑梗死或脑出血,部分患者可能合并肺部疾病等情况,LAAC术前应根据患者的临床情况进行头颅CT或磁共振、胸部CT和肺功能检查,以及其他血液学检查,以便充分了解患者术前的基线资料和对手术风险进行评估。
(二)围术期用药
1.围术期抗凝:
一旦患者经评估具备LAAC适应证,并同意手术,门诊即开始启动抗凝治疗直至入院,入院后根据术前用药情况继续或进一步调整用药。
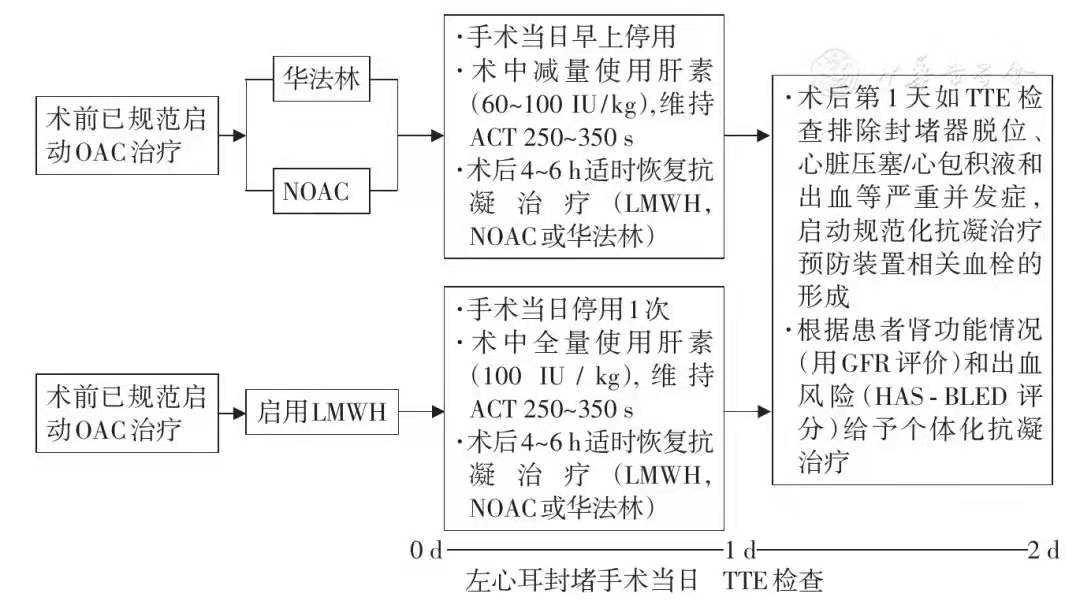
术前服用NOAC者,术前1 d继续使用,手术当日早上停用1次;术前服用华法林者,每天监测国际标准化比值(INR),术前1 d继续使用,手术当日早上停用。术前服用NOAC或华法林者,术中通常减量使用普通肝素(60~100 IU/kg),监测活化凝血时间(ACT),维持在250~350 s(根据手术时间长短可能需要多次监测ACT,必要时追加肝素)。
术前未接受抗凝治疗者,入院后直接给予低分子肝素皮下注射直至手术前1 d,手术当日早上暂停1次,术中使用常规剂量普通肝素(100 IU/kg),监测ACT维持在250~350 s(根据手术时间长短可能需要多次监测ACT,必要时追加肝素)。
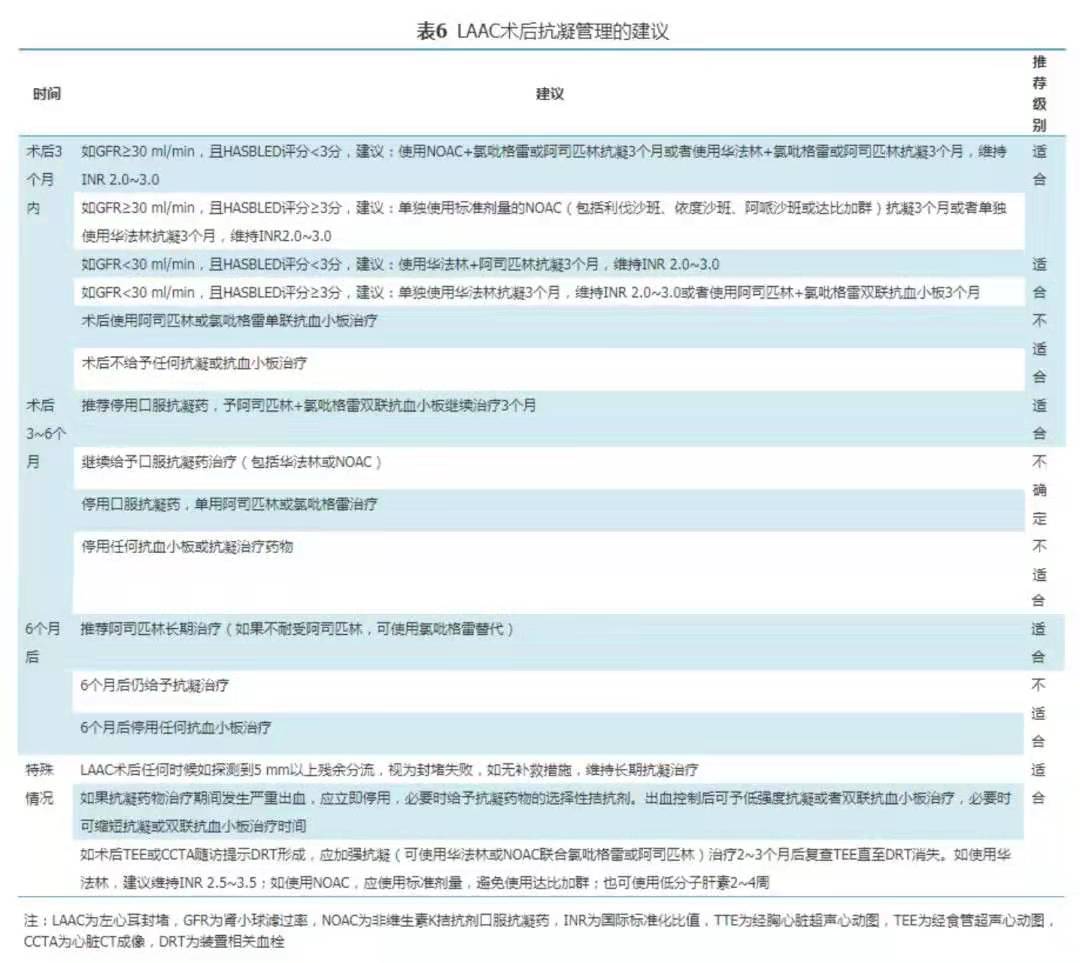
手术结束后当日如排除急性心脏压塞、心包积液或其他严重出血性并发症,根据肝素代谢时间(通常术后4~6 h)适时启用抗凝治疗(如低分子肝素、华法林或NOAC)。术后24 h内常规行TTE,排除封堵器脱位、心包积液(包括新发心包积液和原有心包积液明显增多情况)及其他出血并发症后,术后次日根据患者肾功能情况和出血风险高低给予个体化的抗凝治疗方案(图1,表6)。
OAC:口服抗凝药,NOAC:非维生素K拮抗剂口服抗凝药,LMWH:低分子肝素,ACT:活化凝血时间,TTE:经胸心脏超声心动图
图1 左心耳封堵围术期抗凝方案推荐
2.其他用药:
LAAC术中常规使用TEE监控,部分患者可能还接受导管消融+LAAC一站式联合手术,术中易发生食管黏膜损伤,甚至导致应激性消化道溃疡,如合并射频消融罕见情况还可能导致心房食管瘘,因此本共识建议LAAC手术当天起应常规静脉使用质子泵抑制剂直至出院,出院后口服质子泵抑制剂2~4周。
(三)术前护理准备
进行常规心血管介入治疗术前护理,拿掉义齿,开放静脉,术前8 h禁食、禁饮、禁口服药等。
(四)手术计划
术前应复习患者临床和相关检查资料,再次确认LAAC手术适应证、禁忌证或排除指征。术者还应根据术前TTE、TEE或左心房CCTA等结果,充分了解患者左心耳解剖特征(包括开口直径、可用深度、梳状肌分布和分叶等),左、右心房大小,心包积液及程度,以及是否做过房间隔修补术或封堵术,是否合并肺部手术、胸廓畸形、心脏转位等特殊情况,预判房间隔穿刺难度,可能选择的封堵器类型及尺寸,制定合理的操作方案及可能的替代措施。
六、LAAC手术过程
(一)术中麻醉
全身麻醉状态下,不仅有助于实施全程TEE监控和指导,而且患者处于制动状态,受呼吸影响小,LAAC手术成功率高,并发症发生率低。即使术中发生封堵器脱位、心脏压塞等严重并发症时,手术医生也可得心应手处理。目前包括美国、欧洲和中国的多数心脏中心在实施LAAC手术时常规使用全身麻醉。尽管有小样本文献报道,采用局部麻醉+ICE指导与全身麻醉+TEE指导下的LAAC成功率相当[53,54],但局部麻醉下实施LAAC术中可能因为患者活动和呼吸影响降低封堵成功率和增加发生并发症的风险。因此,建议LAAC手术应当经麻醉科医师专业评估后常规在全身麻醉下施行(表7)。
(二)TEE在LAAC术中的应用
TEE对LAAC术中的辅助作用非常重要,包括:指导房间隔穿刺,跟踪输送鞘、导丝和猪尾导管在左心房内走行位置,指导左心耳封堵器的定位及释放,评价牵拉试验结果和封堵效果,以及术中监测心脏压塞和血栓等并发症情况。因此,建议在LAAC术中应当常规实施全程TEE监控和指导(表8)。
1.术前TEE再次评估:
通常在麻醉之后先插入TEE探查左心房和左心耳,再次确认左心房或左心耳内是否存在血栓(包括云雾状回声),并明确心包积液情况。如探测到左心房或左心耳内血栓或疑似血栓,应立即停止继续手术,予规范抗凝2~3个月后复查TEE,如血栓或疑似血栓消失,可考虑安排择期手术。
2.TEE指导房间隔穿刺:
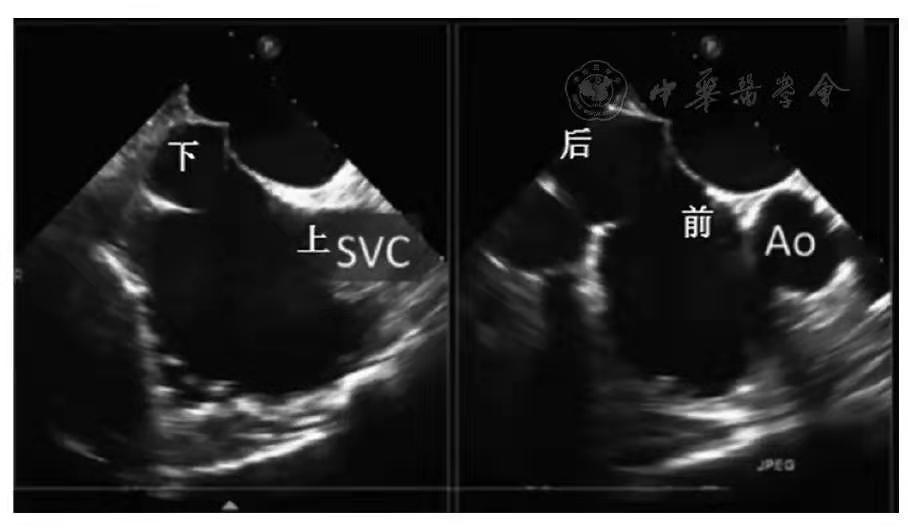
TEE可清晰显示房间隔位置和引导穿刺针在房间隔合适位置穿刺。通常情况下,TEE在90°~100°从上、下腔静脉切面清晰显示上、下位置;在45°~50°从主动脉短轴切面显示前、后位置(靠近主动脉为靠前)。房间隔穿刺时,TEE采用Multi-D模式同时显示房间隔的上、下、前、后位置,引导穿刺针在房间隔合适位置(通常选择靠下、靠后位置)穿刺(图2)。
图2 TEE显示常用的房间隔穿刺位置(靠后、靠下;SVC:上腔静脉,AO:胸主动脉)
3.TEE在LAAC术中监控和指导封堵器释放中的作用:
LAAC术中,TEE全程监控不仅可及时探测血栓,心包积液和心脏压塞等并发症情况,对指导封堵器在左心耳内的定位、释放和评估释放后效果也至关重要。封堵器在心耳内打开后,在释放之前应常规使用TEE多角度(0°、45°、90°和135°)观察和评估,判定封堵器位置是否合适、是否有残余分流及分流程度(观察残余分流应使用彩色血流显示)、露肩程度、封堵器大小是否合适(理想的压缩比8%~30%)。同时还可在TEE监控下行牵拉试验,观察牵拉试验后封堵器是否移位,判断封堵器的稳定性。如果TEE评估提示封堵器在心耳内打开位置理想(position,P),固定牢靠(anchor,A),左心耳开口封堵完全(seal,S)、大小合适(压缩比符合要求)(size,S),即符合封堵器释放的"PASS"原则(以Watchman封堵器为例),则可以完全释放封堵器。
(三)ICE在LAAC术中的应用
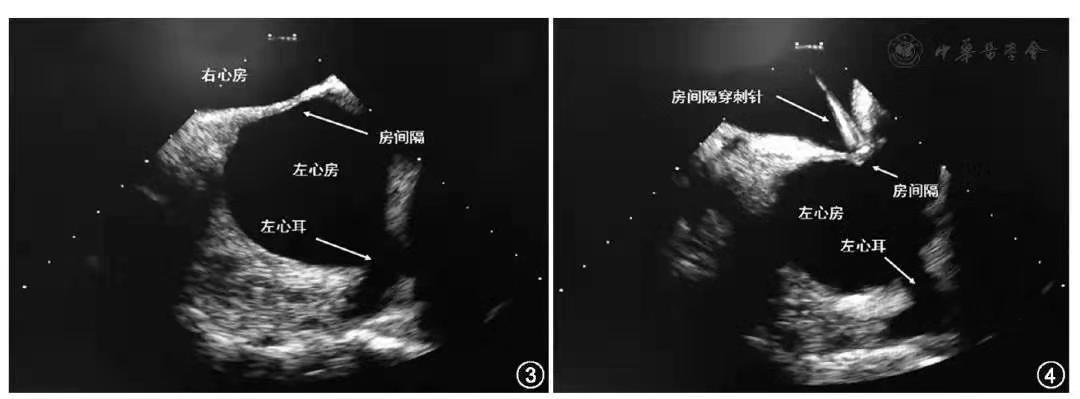
对不能耐受TEE检查和全身麻醉的特殊患者,在术前通过CCTA检查排除左心房/左心耳内血栓的情况下,有条件的单位和有经验的术者,可考虑使用ICE替代TEE在局麻/镇静下实施LAAC手术(表8)。使用ICE指导LAAC手术的常规操作流程如下:穿刺左侧股静脉置入10 F或11 F血管鞘,将ICE导管沿下腔静脉送入右心房等部位,通过调节操作手柄观察房间隔、左心房/左心耳内有无血栓,并初步明确左心耳解剖情况[55,56](图3)。在确认左心房/左心耳内无血栓情况下,继续在ICE指导下穿刺房间隔(图4)。房间隔穿刺完成后,经房间隔穿刺鞘送入加硬长导丝至左上肺静脉,并交换封堵器输送鞘来回充分扩张房间隔穿刺点。然后,固定导丝在左上肺静脉,回撤输送鞘至右心房侧,再将ICE导管经房间隔穿刺点送入左心房或左上肺静脉内先观察左心耳的心态、结构及血栓情况。进一步确认左心耳解剖适合封堵后,保留ICE导管在左心房/左上肺静脉内,再沿长导丝将封堵器输送鞘送至左心房继续LAAC术和ICE评估过程[57](图5)。
图3 心腔内超声在右心房观察房间隔、左心房和左心耳形态
图4 心腔内超声指导下房间隔穿刺
图5 心腔内超声在左心房内指导和评估封堵器释放(5A:红色箭头所示为Watchman封堵器,5B:红色箭头所示为LAmbre封堵器)
文献报道,使用ICE指导的LAAC与TEE指导的LAAC手术成功率相当[58,59]。尽管使用ICE指导的左心耳封堵,可避免全麻、减少术中食道损伤、减少X线暴露及造影剂使用量,但其缺点是观察角度有一定限制,费用较贵,术者也有一定学习曲线,目前仅作为TEE的补充用于LAAC手术。
(四)房间隔穿刺
在正位X线透视下,沿0.032英寸(1英寸=0.025 4 m)长钢丝送入房间隔穿刺鞘至上腔静脉,然后退出钢丝,送入连接造影剂的穿刺针(通常根据左右心房大小塑成一定弯形)在接近鞘顶端1 cm处固定。在Multi-D模式TEE指引下,缓慢回撤房间隔穿刺鞘至房间隔部位。当鞘尖顶住房间隔时,TEE观察下显示"帐篷顶"现象,如果"帐篷顶"在TEE的上、下腔切面和主动脉短轴切面观显示上、下及前、后位置合适(常用穿刺点位于房间隔靠下、靠后位置)(图2),然后在右前斜位45°X线下将穿刺针缓慢送至穿刺鞘顶端,并适当顺时针旋转刺破房间隔,然后从穿刺针注射少量对比剂(或者注射少量生理盐水,TEE显影下左心房呈水泡征),判断针尖是否进入左心房。穿刺针尖进入左心房后右手固定,再将穿刺鞘缓慢送入左心房少许,然后回到正位在X线下固定穿刺鞘,缓慢回撤穿刺针,送入导引钢丝至左上肺静脉,接着将穿刺鞘穿过房间隔并来回充分扩张穿刺点后再送入左上肺静脉。如果房间隔穿刺部位较韧或较厚,穿刺针通过困难,可使用穿刺针针芯或冠脉介入导丝尾端(硬端)顶住房间隔穿刺点穿刺,必要时辅用外科手术电刀(选用电切功能10~20 W,通电<2 s)。房间隔穿刺成功后,沿鞘管补充适量肝素(通常按60~100 IU/kg给予肝素),肝素给药约5 min后,抽血监测ACT,维持ACT在250~350 s(如手术时间过长需重复监测,必要时追加肝素)。对于存在肝素抵抗或肝素诱导血小板减少症或极高危出血风险患者,术中可使用比伐芦定替代肝素。
(五)左心耳造影和封堵器释放
1.左心耳造影和测量:
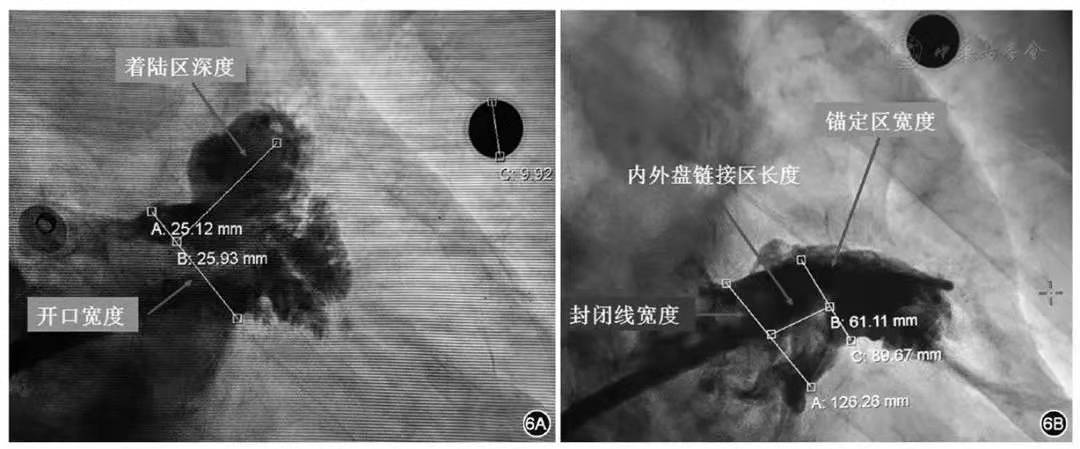
房间隔穿刺完成后,撤出房间隔穿刺鞘内芯和钢丝,再沿外鞘送入2.6 m长0.035英寸加硬钢丝(通常使用头端有7 cm软端的J头Supper Stiff Amplatz加硬钢丝)至左上肺静脉远端,然后固定钢丝撤回房间隔穿刺鞘,沿加硬钢丝小心将左心耳封堵输送鞘送至左上肺静脉口部。然后回撤钢丝和输送鞘内芯,送入猪尾巴导管(5 F或6 F)至左上肺静脉口部。通常在右前斜位30°+足位20°位置(或者调整至左心耳最佳展开位置),X线透视下将猪尾导管尾端朝向心耳最深部位,封堵器输送鞘送至左心耳口部,沿输送鞘冲水管(排除空气)和猪尾导管(排除空气)同时由慢而快注射对比剂,让左心耳口部和心耳底部各个分叶充分显影。清晰显示左心耳形态、开口和分叶,然后DSA测量左心耳开口最大直径,最大可用深度(锚定区深度),并在手术屏幕上用白板笔画出左心耳轮廓(锁定DSA位置),确定左心耳封闭线、锚定区和工作轴线(内塞式封堵器和外盖式封堵器左心耳封闭线、锚定区和工作轴线存在较大差别,图6)。
图6 左心耳造影测量图(6A表示以Watchman为代表的内塞型封堵器的造影测量图,6B表示以LAmbre为代表的外盖式封堵器的造影测量图)
2.内塞型封堵器放置过程及TEE评价:
Watchman封堵器是最常用的内塞型封堵器,以该封堵器为例介绍内塞型封堵器释放和评价过程。根据DSA测量的左心耳开口直径和最大可用深度大小,并结合TEE的测量值(通常TEE测量值比DSA测量值偏小),选择合适尺寸的封堵器(通常选择封堵器尺寸比左心耳开口测量值大4~6 mm)。然后体外准备封堵器,确认封堵器与推送杆连接牢靠,反复冲水排除空气后再次确认封堵器头端位置是否与推送系统头端标线吻合(左心耳深度不够时,可适当在输送鞘头端标线远端5 mm的预留空间预借一定深度)。然后根据屏幕上指示的左心耳轮廓,术者首先沿预定的工作轴线将猪尾导管送入左心耳目标锚定区深处,再小心将输送鞘送至目标锚定区。然后术者左手固定输送鞘,右手小心撤回猪尾导管,松开阀门让血液从输送鞘流出排除空气,在助手持续冲水状态下小心送入封堵器推送系统,送入一半后,将封堵器推送系统尾端冲水管连接对比剂,然后将封堵器缓慢送至Watchman输送鞘头端标记线位置对齐(封堵器推送至输送鞘头端附近时,助手可推注少量对比剂观察输送鞘顶端与左心耳远端心耳壁的距离,如距离太近,可稍许回撤输送系统)。封堵器到位后,锁死输送鞘和推送系统,助手拧松推送系统阀门,随后术者右手固定推送杆,左手小心回撤输送鞘,缓慢展开封堵器,完成封堵器预释放。预释放后,拧紧推送系统阀门,注射对比剂(推荐切线位造影,必要时大角度足位造影)观察是否存在残余分流。同时用TEE从不同角度(0°、45°、90°和145°)观察封堵器位置、露肩、残余分流和压缩比(8%~30%比较合适)情况。如封堵器位置合理,无明显露肩(露肩部分应小于封堵器尺寸的1/4~1/3),完全封堵(无残余分流或仅存在<5 mm的小量残余分流),封堵器位置良好,在TEE观察下或DSA透视下作牵拉试验,直到最后一次牵拉与前一次牵拉比较无位置改变,压缩比无明显变化,符合封堵器释放的"PASS"原则,则可完全释放封堵器。如预释放后TEE多角度评估显示封堵器存在位置不佳、明显残余分流、封堵器尺寸不合适、或封堵器形态与心耳不匹配等情况,则不符合封堵器释放的"PASS"原则,可微回收、半回收或全回收封堵器,调整位置或更换其他型号的封堵器。封堵器完全释放后,最后造影再次评估左心耳的封堵效果,并再行多角度TEE检查,观察并记录封堵器完全释放后最终位置、露肩、残余分流和压缩比情况。
3.外盖型封堵器的释放过程及TEE评价:
外盖型封堵器包括LAmbre、ACP/Amulet、LACbes等封堵器,在设计理念和释放过程上与以Watchman为代表的内塞式封堵器存在较大差别。外盖型封堵器主要在左心耳开口处进行植入操作,对左心耳的深度要求不高,但由于封堵时需要考虑固定伞和封堵盘与输送鞘之间需要有良好的轴线,因此与内塞式封堵器一样对房间隔穿刺位置和轴向要求较高。此外,外盖型封堵器封堵盘(外盘)往往较大,封堵时需要考虑对周边组织(如肺静脉和二尖瓣)的影响,同时也要考虑封堵器释放后封堵盘出现移位(向外翘边或向内陷入)的情况。
LAmbre封堵器是目前国内使用最为广泛的外盖式封堵器,与其他外盖型封堵器类似,由固定伞(内盘)和封堵盘(外盘)构成,外盘大,内盘小,两盘之间通过钢缆链接,并配有小伞大边型特殊设计型号,预装状态下封堵盘与固定盘相距10 mm,同样适用于不同解剖形态的心耳的封堵。此外,该封堵器输送鞘为10~12 F,小于Watchman封堵器输送鞘(14 F),对股静脉穿刺部位和房间隔的损伤较小。在封堵器释放过程和食道超声评价方面也与以Watchman为代表的内塞式封堵器存在较大差别,具体过程如下。
右前斜位30°+足位20°左心耳造影完成后,结合DSA测量结果和TEE测量值,按使用说明书的推荐尺寸选择合适大小的封堵器。一般情况下,选择比锚定区大2~6 mm的封堵器。若开口部直径比锚定区大6 mm及以上,则考虑选择特殊形状封堵器(小伞大盘型)。然后封堵器在体外预装,并经过反复冲水排气后,推动封堵器输送钢缆,将封堵器送往输送鞘头端标记环处,再缓慢推出封堵器向前释放固定盘(内盘);然后固定推送杆,回撤输送鞘,释放封堵盘(外盘)。封堵器外盘展开后,在释放前需要造影和多角度(0°、45°、90°、135°)TEE检查,评估封堵器释放效果是否符合"COST"原则,即:C指回旋支(circumflex artery),封堵器固定盘要确保在回旋支口部远端打开;O指充分打开(open fully),确保封堵器固定盘在锚定区充分展开;S指密封(sealing),封堵器外盘要达到最佳的密封效果(要求残余分流≤3 mm);T指牵拉试验(tug test),在释放前需要牵拉封堵器固定盘,确保封堵器的稳定性。此外,封堵器外盘展开后也应观察是否影响二尖瓣、左上肺静脉等周围结构,牵拉试验后外盘是否出现移位(外盘一侧是否出现翘边、内陷)等情况。如果TEE检查提示封堵器完全封堵左心耳开口,左心耳周围结构如二尖瓣和左上肺静脉无受累,行牵拉试验并直到最后一次牵拉与前一次牵拉比较无位置改变,提示封堵器固定牢固,符合"COST"原则后方可解脱钢缆完全释放封堵器。完全释放后,再次复查TEE,评估封堵器完全释放后有无移位,残余分流和周围结构影响情况(表8)。
(六)穿刺部位止血及处理
LAAC术完成后,缓慢撤出输送鞘,对股静脉穿刺部位可压迫止血或者"8"字缝合止血,压迫或缝扎止血后确认无出血情况下,采用多层纱布包扎和弹力绷带固定,然后用沙袋压迫6~8 h。
七、术后观察及护理(住院期间)
1.生命体征和心脏体征:LAAC术后常规心电监护24 h,密切观察心率、血压、呼吸和氧饱和度情况。因患者术中使用全身麻醉和镇静药物,术后需密切观察是否存在呼吸抑制和误吸等情况。需警惕尿潴留,必要时及时导尿处理。
2.心脏压塞和心包积液情况:除术中发生急性心脏压塞情况外,少数患者可能出现迟发性或慢性心包积液(可能与封堵器压缩比过大或反复牵拉力量过大时,封堵器倒钩刺穿心耳壁引起的少量出血有关)。因此患者返回病房后,应密切观察是否有不良主诉(如胸闷、气促、烦躁等)和不良体征(如面色苍白、出冷汗、脉搏微弱、心动过速或过缓、血压降低等),一旦出现上述情况,需考虑急性心脏压塞,立即床边TTE检查,如确诊,需行紧急心包穿刺引流;如不能改善,需要心脏外科心包切开引流和修补。除发生急性心脏压塞症状需要立即床边TTE检查外,术后24 h内应常规复查TTE,明确封堵器是否在位,有无迟发心脏压塞和心包积液等情况。
3.术后24 h内需要密切观察穿刺部位血肿情况,判断有无穿刺并发症。术后第2天如排除穿刺部位严重并发症,TTE检查提示封堵器在位,无心脏压塞或明显心包积液等情况,启动规范抗凝,术后2~3 d出院。
八、LAAC术后抗凝管理及影像学随访
(一)LAAC术后抗凝管理及装置相关血栓的预防
尽管LAAC预防房颤卒中的疗效和安全性已被随机对照研究[2,3,4,5,34]及多个注册研究[6,7]的中长期证据所证实,但LAAC术后并不低的装置相关血栓(device related thrombosis,DRT)发生率(3.7%~7.2%)[3,60,61,62,63,64]和潜在增加的卒中风险[62]也需引起足够重视。
LAAC术后DRT的发生除与封堵器械、操作和患者自身因素有关以外,也与LAAC术后采用的抗凝强度及持续时间长短也密切相关。然而,迄今为止LAAC术后采用何种抗凝方案最能有效预防DRT,仍缺乏高质量的前瞻性RCT研究,现有指南也未给予具体推荐。除PROTECT AF和PREVAIL研究在LAAC术后给出了具体抗凝方案外[阿司匹林+华法林45 d,TEE排除DRT后阿司匹林+氯吡格雷双联抗血小板治疗(DAPT)直至6个月,然后维持阿司匹林长期治疗],在真实世界的临床实践中,LAAC术后抗凝方案和持续时间上并无统一标准。因为PROTECT AF和PREVAIL研究的抗凝方案是针对可耐受华法林患者,真实世界里常有一些高危出血风险的患者,医生对抗凝多有顾虑。在2018年报道的法国注册研究中,所有487例接受LAAC的患者中,仅有4.6%术后口服抗凝药(OAC)+单药抗血小板治疗(SAPT),28.9%单用OAC、23.2%使用DAPT、35.8%使用SAPT预防DRT,却有高达7.7%的患者术后未使用任何抗凝或抗血小板治疗[62]。在Ewolution注册研究中,所有成功植入封堵器的患者术后3个月内采用SAPT、DAPT和OAC者分别为7%、60%和27%,且有6%的患者术后未进行抗凝或抗血小板治疗;术后3~6个月采用SAPT占55%,DAPT占28%,OAC占8%,也有9%的患者未接受抗凝或抗血小板治疗[61]。
Pioneer-AF PCI研究[65]、RE-DUAL PCI研究[66]和AUGUSTUS[67]研究已证实房颤合并冠心病并接受PCI的患者使用NOAC(利伐沙班、达比加群或阿哌沙班)+氯吡格雷(75 mg)联合治疗6~12个月的安全性(TIMI大出血年发生率1.4%~2.1%),尤其AUGUSTUS研究[67]结果还显示阿哌沙班+氯吡格雷联合治疗的出血风险明显小于华法林+阿司匹林。上述数据表明,"NOAC+氯吡格雷"的联合方案用于LAAC术后的抗凝管理有可能是"华法林+阿司匹林"的有效替代。此外,有限证据显示,LAAC术后采用一种抗凝加一种抗血小板的联合方案预防DRT的效果优于DAPT或SAPT[68]。鉴于接受LAAC的房颤患者,多数具有较高的卒中风险,出血风险差异较大,而且部分患者因存在严重的肾功能不全不能耐受NOAC,因此,本共识建议LAAC术后DRT的预防应根据患者肾功能情况[用肾小球滤过率(GFR)评价]和出血风险(用HAS-BLED评分评价)给予以下个体化的抗凝方案。
1.当患者无严重肾功能不全(GFR≥30 ml/min)时:
(1)如果出血风险小(HAS-BLED评分<3分),LAAC术后采用NOAC或华法林+氯吡格雷或阿司匹林联合治疗3个月,3个月时复查TEE,如果排除DRT和>5 mm的残余分流,改用阿司匹林+氯吡格雷双联抗血小板治疗3个月。(2)如果出血风险较高(HAS-BLED评分≥3分),术后单独使用常规剂量的NOAC或华法林治疗3个月;3个月时复查TEE,如果排除DRT和>5 mm的残余分流,改用阿司匹林+氯吡格雷继续治疗3个月。术后6个月时复查TEE,如排除DRT和>5 mm的残余分流,予阿司匹林长期维持治疗(如阿司匹林不耐受,可用氯吡格雷替代)。
2.当患者存在严重的肾功能不全(GFR<30 ml/min)时(大多数NOAC使用存在禁忌证或慎用情况):
(1)如果出血风险小(HAS-BLED评分<3分),LAAC术后使用华法林+阿司匹林联合抗凝3个月(维持INR 2.0~3.0),3个月时复查TEE,如果排除DRT和>5 mm的残余分流,改用阿司匹林+氯吡格雷继续治疗3个月。(2)如果出血风险较高(HAS-BLED评分≥3分),建议在严密监测INR情况下(维持INR 2.0~3.0)单用华法林抗凝3个月,3个月时复查TEE,如果排除DRT和>5 mm的残余分流,改用阿司匹林+氯吡格雷继续治疗3个月;或者LAAC术后直接使用阿司匹林+氯吡格雷双联抗血小板治疗6个月。6个月时复查TEE,如果排除DRT和>5 mm的残余分流,则改用阿司匹林长期治疗维持(如阿司匹林不耐受,可用氯吡格雷替代)。
3.特殊情况:
(1)如果LAAC术后任何时候TEE或CCTA探测到5 mm以上残余分流,均视为封堵失败,假设没有补救措施,则需要长期维持口服抗凝治疗。(2)如果术后任何时候TEE探测到DRT,应加强抗凝(可使用华法林或NOAC+阿司匹林或氯吡格雷)治疗2~3个月后复查TEE直至DRT消失。根据有限证据,如果使用华法林方案,建议维持INR 2.5~3.5;如果使用NOAC,建议使用标准剂量利伐沙班或阿哌沙班,避免使用达比加群[69];也可使用低分子肝素抗凝治疗2~4周。(3)如果术后抗凝药物治疗期间发生严重出血,应立即停用,必要时给予抗凝药物的选择性拮抗剂。出血控制后可予低强度抗凝或双联抗血小板治疗,必要时缩短抗凝/双联抗血小板时间(表6)。
(二)TEE或CCTA随访
LAAC术后存在一定的DRT发生率,一旦发生DRT没有及时探测或没有给予强化的抗凝措施,可能增加缺血性卒中和其他系统性血栓栓塞事件的风险。因此本共识建议:接受LAAC手术的患者应常规在术后3和6个月各随访TEE 1次(如果患者不能耐受或拒绝TEE,可用CCTA替代)。如果探测到DRT,应当强化抗凝2~3个月后再复查TEE观察DRT变化情况,必要时可增加随访次数。如果探测到>5 mm的残余分流,视为LAAC失败,如无补救措施,应维持长期抗凝治疗。
(三)TTE随访
LAAC术后常规复查TTE,不仅可探测到封堵器是否在位,明确是否存在心包积液及程度,还可评估心脏收缩和舒张功能、明确瓣膜功能及病变情况,以及其他解剖结构变化。LAAC术后1、3和6个月各进行1次TTE检查是合理的(表9)。
九、LAAC围手术期并发症的识别及处理
1.心包积液与心脏压塞:
心包积液与心脏压塞是LAAC术中最严重的并发症之一,一旦发生需要积极识别和处理。在PROTECT AF研究[2]和PREVAIL[3]研究中,LAAC组分别有4.8%和1.9%的患者发生了需要外科修补或心包穿刺引流的心包积液/心脏压塞;在随后的CAP注册研究[70],美国3 822例LAAC上市后临床研究[71]和EWOLUTION注册研究[72]中,心包积液发生率分别2.2%、1.02%和0.5%。这表明,随着器械的不断改进以及术者经验的积累和操作的规范化,LAAC围手术期发生心包积液和心脏压塞的比率明显降低。
发生心包积液和心脏压塞并发症的原因与LAAC手术操作和封堵器有关,包括:(1)房间隔穿刺时,穿刺针或穿刺鞘刺破心房或主动脉根部;(2)导丝或导管操作不当刺破左心房或心耳;(3)封堵器放置过程中操作不当导致前端刺破心耳;(4)封堵器回收过程划破心耳;(5)封堵器牵拉过程中用力过猛撕裂心耳。如果术中或术后患者出现不明原因的血压下降、脉压减小、心率增快,应首先行TTE检查明确是否发生心包积液/心脏压塞。LAAC术中可TTE检查确认,在X线透视下则可见心影增大,搏动减弱,心包腔内对比剂显影等征象。心脏填塞会危及生命,首先应立即行心包穿刺引流,若出血量不大并且出血速度较慢可抽出积血后观察;若出血量较大、较快时,需置入猪尾导管持续心包引流,同时作静脉自体回输。以上措施仍无改善者,应在保持引流情况下尽早外科心包切开引流术并修补破口。
2.空气栓塞与血栓栓塞:
空气栓塞或血栓栓塞可发生在全身各动脉,多见于冠状动脉和脑动脉,产生相应供血区的缺血/栓塞症状。空气栓塞发生原因多与操作相关,包括:(1)房间隔穿刺导管或封堵器装置系统排气不彻底,导致气体进入左心房;(2)从输送鞘回撤猪尾导管过快,造成鞘管内负压而吸入气体,在送入封堵器时,将鞘管内气体推入左心房;(3)左心房内压力过低[如压力<10 mmHg(1 mmHg=0.133 kPa)甚至负压],导致鞘管内负压而吸入气体导致空气栓塞。如左心房压力过低(如<10 mmHg),应快速补液,或用大针筒直接通过鞘管向左房补充液体,直至左房压升至10 mmHg以上方可继续LAAC操作。
血栓栓塞的常见原因包括:(1)术前未抗凝或抗凝不充分;(2)术中导管、导丝肝素化盐水冲洗不够;(2)术中肝素抗凝不充分,或手术时间过长疏于ACT监测和补充肝素不及时;(3)部分患者属于高凝体质或存在肝素抵抗;(4)术前或术中左心房/左心耳内发生血栓未及时发现(封堵术前应先TEE或ICE探查,确保左心房/左心耳无血栓情况下方可继续后续操作;X光造影/透视条件下不容易探测血栓,单纯在X线指导下实施LAAC可能增加术中血栓并发症的风险)。
LAAC术中发生空气或血栓栓塞可通过术前和术中规范抗凝、术中装置系统充分肝素水冲洗和排气,以及规范操作等措施避免。如发生严重的冠状动脉空气或血栓栓塞,可导致急性心肌梗死,需按急性心肌梗死的救治原则处理。对怀疑脑梗死的患者,应及时进行头颅CT检查,诊断明确后按急性脑梗死处置原则治疗。
3.封堵器脱落:
封堵器脱落是LAAC手术最严重的并发症之一,多发生在围术期内。根据封堵器脱落的位置不同,相应的临床表现也不相同。封堵器脱落至胸主动脉或腹主动脉时临床上可无任何表现,但可在TTE时发现;封堵器脱落至左心房或左心室内可引起二尖瓣功能障碍或左心室流出道梗阻,症状表现为心悸、胸闷,严重者出现室性心律失常甚至危及生命。
封堵器脱落主要原因包括:(1)封堵器尺寸相对于心耳口径过小;(2)封堵器放置太靠外,固定不牢固;(3)封堵器预装不牢固,或封堵器全回收后推送杆与封堵器连接处发生解螺旋。因此,封堵器冲水时需要事先检查封堵器与推送杆连接是否牢固,封堵器全回收后应顺时针旋转推送杆2~3圈确保封堵器与推送杆链接牢靠,从而避免封堵器推出输送鞘管后发生脱落。
封堵器脱落时,通常情况用圈套器或异物钳将脱落的封堵器固定或调整至相对安全并且容易抓取的心腔内,再抓取封堵器并沿鞘管注射冷生理盐水使封堵器变软,然后将其回撤至鞘管内。抓取时,注意轻柔操作,避免造成瓣膜、血管及重要脏器的医源性损伤,以免引起其他严重并发症。当用介入方法取出封堵器预期比较困难或者存在很大风险时,建议心外科手术取出。
建议开展左心耳封堵术的中心,常规备有圈套器、异物钳、15 F可调弯鞘、14~16 F抗折鞘、血管缝合器,以便发生封堵器脱落时可及时处理。
4.血管损伤:
经股静脉途径操作,外周血管并发症相对较少。但若伤及动脉则可能出现穿刺部位出血、血肿、股动脉假性动脉瘤和股动静脉瘘等血管并发症,部分股动脉假性动脉瘤或股动静脉瘘可通过局部压迫血管破口闭合,若不成功,可置入覆膜支架或外科手术修补破口。
5.封堵器对毗邻结构的影响:
封堵器植入心耳后,主要依靠倒钩刺入心耳壁进行固定,需要考虑封堵器及其倒钩对毗邻组织的影响。文献报道,盖式封堵器的外盘过大可磨损二尖瓣瓣叶和导致二尖瓣反流的发生[73];封堵器的远端如果压缩比过大或者倒钩较为突出,可引起肺动脉损伤[74],这种情况多见于同时合并肺动脉扩张的患者。盖式封堵器在操作过程应注意其对毗邻的二尖瓣或肺静脉结构的影响,避免影响二尖瓣或肺静脉的正常功能,术后随访期间也应使用TTE/TEE观察封堵器延迟移位对这些毗邻结构的影响。
十、LAAC的其他问题
(一)导管消融+LAAC一站式联合治疗
导管消融可恢复窦性节律和缓解症状,但不能降低卒中风险;而LAAC可预防卒中,减少长期抗凝治疗引起的出血风险,但不能恢复窦性节律和缓解症状。对于既具有高卒中风险、又具备消融指征的症状性房颤采用"导管消融+LAAC"一站式联合治疗理论上比单纯导管消融或单纯LAAC可能获益更多。
自2012年荷兰医生Swaans等[75]首次报道了"射频消融+LAAC"一站式联合手术以来,近年来有不少研究证实了"导管消融(包括射频或冷冻球囊)+LAAC"一站式联合治疗的可行性及安全性[76,77,78]。最近一项多中心注册研究显示,在349例接受"导管消融+LAAC"联合治疗的房颤患者中,所有患者LAAC手术均取得了成功,30 d操作相关严重并发症包括5例(1.4%)心包积液,1例(0.3%)卒中,没有其他严重并发症发生;随访35个月后,51%的患者房颤复发,9例患者发生卒中,年卒中事件发生率为0.9%,比基于CHA2DS2-VASc评分预估的卒中风险(3.2%)减少了78%,年出血事件发生率(1.1%)比基于HAS-BLED评分预估的出血风险(3.74%)减少了71%[79]。其他公开报道的几个单中心或多中心注册研究[75,76,77,78]均显示"导管消融+LAAC"一站式联合手术安全可行。此外,关于"导管消融+LAAC"一站式手术中消融和封堵的先后顺序问题,国内有学者率先进行了探讨,结果显示,如果采用以Watchman为代表的"塞式"封堵器进行封堵,采用先消融或先封堵的策略,中远期随访的安全性及有效性相当,但先封堵后消融组术后45 d时的新发封堵器边缘漏比例较低;如采用"盖式"封堵器(如ACP或LAmbre封堵器)行一站式手术,考虑到封堵盘对嵴部的覆盖可能影响后续导管消融,则建议以先消融后封堵的策略进行手术[80]。尽管上述研究从一定程度上证实了"导管消融+LAAC"一站式联合手术的疗效及安全性,但仍然缺乏随机化、对照研究证据。
房颤的治疗应当体现综合管理的理念,既要注重缓解症状(如恢复窦性节律),更要改善预后,尤其是卒中和系统性血栓事件预防。因此,尽管目前"导管消融+LAAC"一站式联合治疗的证据尚不充分,本共识依然建议:对于具有高卒中风险(CHA2DS2-VASc评分≥2分),不能耐受或不依从长期抗凝治疗的NVAF患者,如果存在症状、同时具备导管消融和LAAC适应证,有条件的中心可以施行"导管消融+LAAC"一站式联合术(表10)。
(二)合并房间隔缺损/卵圆孔未闭的LAAC
房间隔缺损(atrial septal defect,ASD)是最常见的成人先天性心脏病,如不接受治疗,随着年龄增加,发生房性心律失常,尤其是心房扑动和房颤的比例升高[81],发生缺血性卒中的风险也增高[82]。ASD引起房颤的机制仍不明确,可能与患者长期左向右分流导致右心房肌增厚和纤维化有关。也有学者认为,ASD患者因右心房增大,左心房受到牵张引发结构改变和电生理重构,肺静脉电位可能也参与该机制。
对于合并ASD或者卵圆孔未闭(patent foramen ovale,PFO)的房颤患者,尽管导管消融作为其治疗一部分,但2012年ESC房颤管理指南和2014、2017年AHA/ACC/HRS指南均建议以更谨慎看待消融效果;对于患者中CHA2DS2-VASc评分2分以上,应给予抗凝治疗。而对于具有高出血风险(HAS-BLED评分≥3分)、不适合或不愿意长期抗凝治疗的患者,或者在服用抗凝药期间仍然发生卒中的患者,可考虑LAAC。
合并ASD或PFO的房颤患者行LAAC存在两种情况:一种是既往曾行外科矫正或者介入封堵的患者,另一种则是未行外科或介入治疗者。前者由于房间隔多存在外科补片或者金属封堵器,房间隔穿刺困难较大,即使穿刺成功也存在房间隔穿刺外鞘或封堵器输送鞘不能通过房间隔的情况。根据上海市胸科医院经验,采用直接穿刺,采取低位穿刺避开补片或者封堵器多能成功穿过房间隔。如补片较大较韧,可采用20 W以上电刀连接穿刺针烧灼房间隔;当封堵器较大覆盖房间隔所有可能穿刺点时,可用穿刺针穿过封堵器盘片,使用冠状动脉介入导丝尾端(硬端)穿过穿刺针针芯并引导针芯进入左心房,然后撤回导丝,将其头端(软端)送入左上肺静脉,再沿导丝用4.0 mm或更大一号的冠状动脉后扩张球囊充分扩张跨封堵器的房间隔穿刺点,直至顺利送入房间隔穿刺外鞘和左心耳封堵输送鞘,以便后续LAAC操作。而对于未行ASD/PFO治疗者,部分患者可通过ASD/PFO缺损直接进行LAAC,如果患者左心耳位置过低,通过ASD/PFO缺损所提供的轴向位置多偏高,需要避开ASD/PFO缺损部位,在房间隔偏后下方位置重新定位穿刺房间隔方可完成封堵。如术前TEE充分评估缺损位置大小后,则可在LAAC同期介入关闭房间隔缺损或者卵圆孔。需特别注意的是如患者ASD病史长,导致肺动脉明显扩张者,LAAC应特别谨慎,必要时先行CT检查以明确左心耳与肺动脉的空间关系。有文献报道,如影像学提示肺动脉和左心耳贴靠非常近,任何类型左心耳封堵器上的倒刺均可透过左心耳影响肺动脉,严重者可致肺动脉撕裂或穿孔出血[74]。此外,如果患者ASD过大,或解剖不适合介入封堵者,可考虑外科修补ASD同期行左心耳切除术,或者ASD外科修补术后择期介入封堵左心耳(表10)。
(三)复杂LAAC
有些左心耳解剖结构比较复杂,LAAC操作难度高,术者需要掌握一定的操作技巧和经验方可完成。可根据心耳形态选择适合类型的左心耳封堵器,操作时要遵循各类左心耳封堵器的操作技巧和释放原则,针对不同心耳选择最优方案。
1.鸡翅型心耳:
如果翅尖向上为反鸡翅,翅尖向下为正鸡翅,两种鸡翅型心耳的开口距离着陆区距离短,缺乏足够深度,而且都缺乏理想的工作轴线,对房间隔穿刺部位要求较高,封堵难度大。如选择内塞型封堵器,以Watchman封堵器为例,对于翅尖向下为正鸡翅,可选择单弯鞘,封堵器装载时可预借适当深度,到位后缓慢释放封堵器(如果张力过大,可连同输送鞘及封堵器稍微向外拉缓慢释放);对于翅尖向上为反鸡翅,选择双弯鞘,并将输送鞘保持逆时针旋转状态,封堵器装载时可预借适当深度,到位后始终保持输送鞘逆时针旋转状态并缓慢释放封堵器。如果预释放后位置不理想,不符合"PASS"原则,不应反复多次调整和回收,可考虑重新穿刺房间隔或换用对深度要求不高的外盖式封堵器如LAmbre封堵器进行封堵[83,84]。
2.菜花状心耳:
菜花状心耳由于梳状肌发达,早分叶,塞式封堵器(如Watchman)往往只能进入其中一个分叶,由于梳状肌阻挡致使封堵器扩张不全,导致不能完全封堵左心耳其他分叶。此种类型心耳,可考虑使用LAmbre封堵器。如果开口与锚定区尺寸差异<10 mm,可考虑使用LAmbre封堵器的常规型号;如目标分叶的锚定区与开口差异>10 mm,可采用小伞大盘型封堵器[78]。如果开口过大(>30 mm),可使用大型号的LAmbre封堵器,如不成功也可采用2个封堵器对吻的"Kissing-Watchman"策略[85,86],使用两个伞进行封堵。因为"Kissing-Watchman"技术要求高,难度较大,仅限于有丰富经验的术者和有条件的中心在使用单封堵器策略无法完成封堵,并充分考虑患者安全情况下才考虑使用。
(四)LAAC团队建设
LAAC团队应由具有独立手术能力的心脏介入、超声和麻醉医生以及围术期护士组成。开展LAAC手术的医院或者所在城市其他医院应当具备心脏外科条件和具有独立手术能力的心脏外科医生,以备紧急情况下提供外科支持。此外,团队还应具有及时识别和处理心脏压塞、封堵器脱位、血管入路并发症的能力,以及相应的临床随访和研究能力。
专家组成员
(执笔:江立生 何奔)
核心专家组成员:何奔(上海市胸科医院 上海交通大学附属胸科医院),马长生(首都医科大学附属北京安贞医院),吴书林(广东省人民医院),江立生(上海市胸科医院 上海交通大学附属胸科医院),陈茂(四川大学华西医院),李毅刚(上海交通大学医学院附属新华医院),宋治远(陆军军医大学第一附属医院),王祖禄(北部战区总医院),姚焰(中国医学科学院 阜外医院),刘少稳(上海市第一人民医院),董建增(首都医科大学附属北京安贞医院),杨新春(首都医科大学附属北京朝阳医院)
专家组成员(按姓名拼音首字母排序):白融(首都医科大学附属北京安贞医院),储慧民(宁波市第一医院),蔡衡(天津医科大学总医院),陈茂(四川大学华西医院),陈绍良(南京市第一医院),陈新敬(福建省立医院),方咸宏(广东省人民医院),管丽华(复旦大学附属中山医院),韩志华(上海交通大学医学院附属第九医院),蒋晨阳(浙江大学附属邵逸夫医院),李松南(首都医科大学附属北京安贞医院),宁忠平(上海市浦东新区周浦医院),潘欣(上海市胸科医院 上海交通大学附属胸科医院),陶凌(空军军医大学附属西京医院),王群山(上海交通大学医学院附属新华医院),谢瑞芹(河北医科大学第二医院),曾杰(四川省人民医院),赵仙先(海军军医大学附属长海医院),张勇华(武汉亚洲心脏病医院),张玉顺(西安交通大学第一附属医院)
参考文献(略)